自噬是近年国自然研究热点,热度居高不下 —— 它在细胞稳态、衰老、免疫、肿瘤及神经退行性疾病等生理病理过程中作用关键,发生还与营养状态、能量状态、氧化应激、缺血缺氧等密切相关。本期特总结细胞自噬的发生机制、检测方法与研究思路,供大家参考学习!
一、自噬的基本知识
1、自噬概念
自噬(autophagy)是II型程序性细胞死亡(凋亡、铁死亡、焦亡也都属于程序性死亡)。是指细胞利用溶酶体降解,选择性地清除自身受损、衰老或过剩的生物大分子和细胞器,释放出游离小分子供细胞回收利用的正常动态生命过程。自噬被认为是机体的一种自我保护机制。
2、自噬种类
🔹巨自噬(macroautophagy):通过形成具有双层膜结构的自噬体(autophagosome)包裹胞内物质,最终自噬体与溶酶体融合。一般情况下所说的自噬是指巨自噬。
🔹微自噬(microautophagy):通过溶酶体或液泡表面的形变直接吞没特定的细胞器。
🔹介导自噬(Chaperone-mediated autophagy,CMA):具有KEFRQ样基序的蛋白在HSP70伴侣的帮助下,通过LAMP-2A转运体转运到溶酶体。
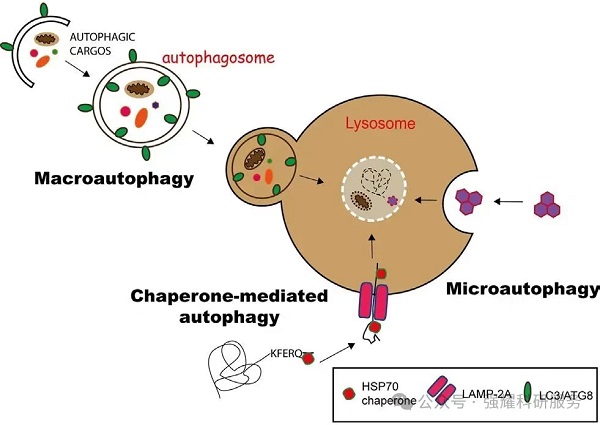
图1. 3种自噬途径
3、自噬的发生过程
自噬的本质其实是细胞内的膜重排,其发生过程大体分为以下4个阶段:
自噬的起始→ 隔离膜和自噬体的形成→ 自噬体与溶酶体融合→ 自噬体的裂解
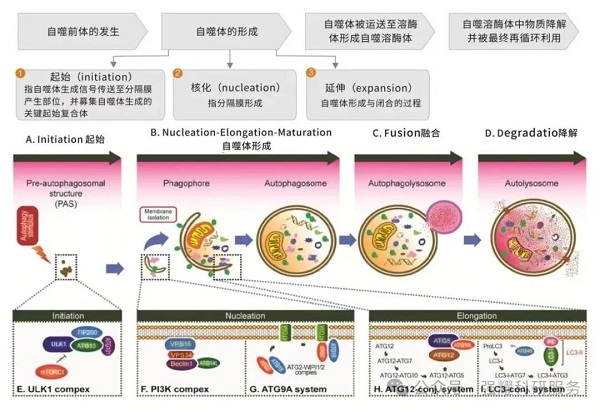
图2. 自噬的发生过程
(1)自噬前体形成:细胞接受诱导信号后,胞质内形成扁平碗状双层膜结构(Phagophore),用于包裹待降解的细胞成分。该结构是自噬启动的形态学证据。
(2)自噬体形成:Phagophore延伸并闭合形成球状自噬体,其典型特征为双层膜结构,内含待降解的胞质成分(如细胞器碎片)。
(3)自噬体成熟:自噬体可与内吞系统成分(吞噬泡、内体等)发生选择性融合。
(4)降解与回收:自噬体与溶酶体融合形成自噬溶酶体,内容物被降解为小分子物质(氨基酸、脂肪酸等)供细胞再利用,未完全降解的残渣则被排出或滞留。
4、自噬的调控
在基础状态下,细胞的自噬活性通常维持在较低水平,不利于直接观察。因此,在自噬研究中常需通过人工干预来增强或抑制自噬过程。
目前常用的自噬激动剂包括Rapamycin(雷帕霉素)和EBSS(饥饿培养基),而常用的自噬抑制剂则有Chloroquine(氯喹)、3-MA、NH4Cl和Bafilomycin A1等。
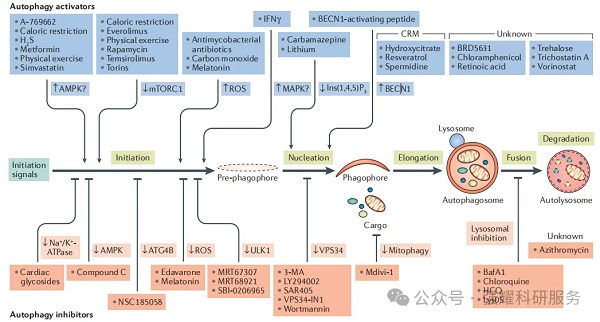
图3. 自噬通路调控药物
5、自噬相关蛋白
自噬过程中,多种自噬相关蛋白(ATG)参与调控其不同阶段。目前,酵母中已鉴定出40多个ATG基因,其中大多数在酵母与哺乳动物间高度保守。在哺乳动物细胞中,约20种核心ATG基因参与饥饿诱导的自噬调控,这些蛋白在液泡周围被持续招募并组装,共同形成自噬前体结构。以下为这些基因的分类与功能概述。
一、ULK1激酶核心复合物:包括ULK1/2、ATG13、RB1CC1/FIP200和 ATG101;
二、PI3K复合物:包括VPS34、VPS15、Beclin1和ATG14L;
三、ATG9A转运系统:包括ATG9A、WIPI1/2和ATG2A;
四、ATG12泛素样结合系统:包括ATG12、ATG7、ATG10、ATG5和ATG16L1;
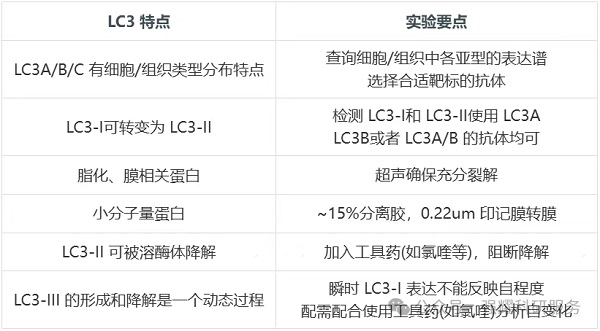
五、LC3泛素样结合系统:包括LC3A/B/C、ATG7、ATG3和ATG4A/B/C/D。
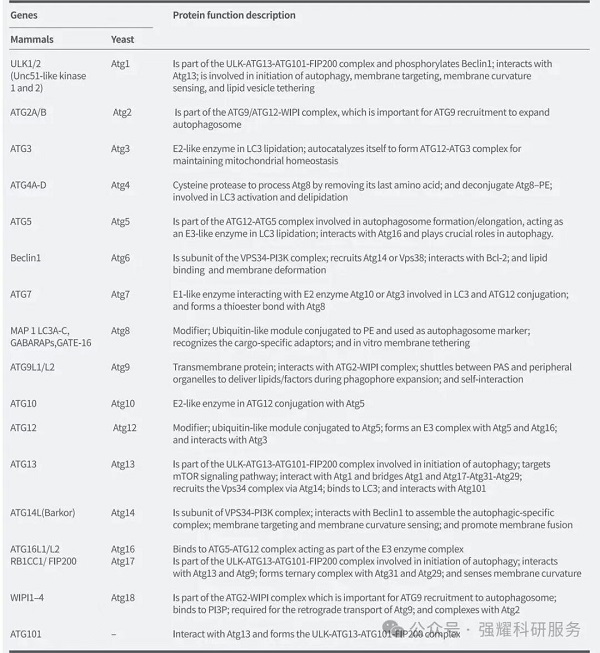
图4. 自噬相关基因及其在自噬中的蛋白质功能
二、自噬的检测方法
在生理条件下,细胞自噬活性通常较低。但在饥饿、缺氧和疾病等刺激下会显著上调。另外,自噬抑制也与某些疾病相关,如癌症、神经退行性疾病等。选择理想的检测方法对于自噬研究至关重要。常用的观察和检测方法有∶
1、透射电镜检测
▫️自噬体作为亚细胞结构,无法通过普通光学显微镜观察。利用透射电子显微镜直接观察自噬过程中各阶段的形态学变化,是目前最为直观的研究方法之一。

▫️透射电镜下可清晰区分自噬小体与自噬溶酶体:自噬小体具典型双层膜结构,内含完整的线粒体等细胞器;而自噬溶酶体为单层膜,其内容物已呈现部分降解状态。
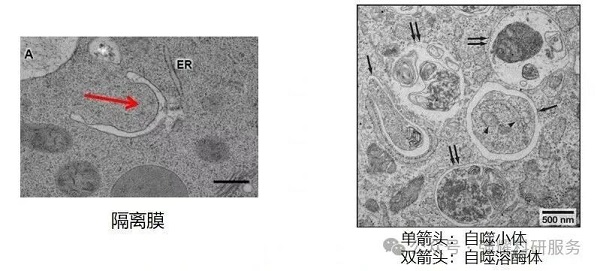
图5. 透射电镜下自噬小体(单箭头)和自噬溶酶体(双箭头)形态
2、双荧光穿梭质粒系统检测
GFP-LC3单荧光和mCherry-GFP-LC3双荧光指示系统:自噬形成时,GFP-LC3或mCherry-GFP-LC3融合蛋白转移至自噬体膜,在荧光显微镜下形成多个明亮的绿色或黄色荧光斑点。当自噬溶酶体形成后,酸性环境使GFP荧光淬灭,而mCherry荧光不受影响,自噬溶酶体呈现红色荧光(图7)。因此,可以通过LC3荧光指示系统来监测自噬流。
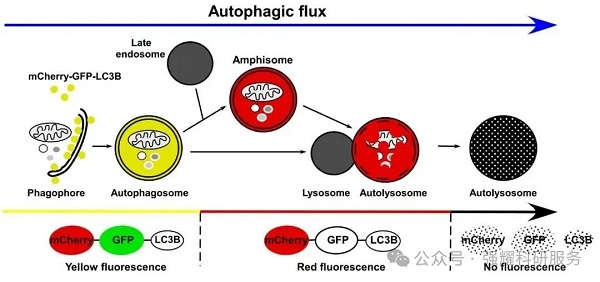
图6. LC3自噬双标系统追踪自噬流不同阶段
3、单荧光质粒系统检测
基于LC3在自噬过程中会聚集至自噬体膜的特性,我们开发了GFP-LC3指示技术。在正常细胞中,GFP-LC3均匀分布于细胞质;当自噬被诱导后,该融合蛋白会定位至新生的自噬体膜上,在荧光显微镜下呈现为明亮的绿色斑点(每个斑点代表一个自噬体)。通过计数这些斑点即可对自噬活性进行定量评估。
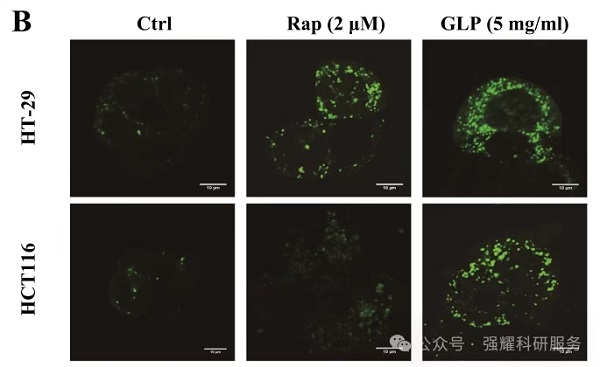
图7. GFP-LC3单荧光质粒系统检测
4、WB检测
(一)LC3-II/I比值法
在自噬激活过程中,胞浆中的LC3-I经蛋白酶切后与磷脂酰乙醇胺(PE)共价结合,转化为膜结合形式的LC3-II。通过Western Blot检测LC3-II与LC3-I的比值变化,可作为评价自噬水平的重要分子标志。
(二)p62蛋白检测法
p62是自噬的关键选择性底物。在自噬过程中,p62通过桥接LC3与泛素化蛋白,被共同包裹进入自噬体,并最终在自噬溶酶体中降解。因此,p62蛋白的表达水平与自噬活性呈负相关,通过Western Blot检测其表达量已成为评价自噬水平的常用方法。
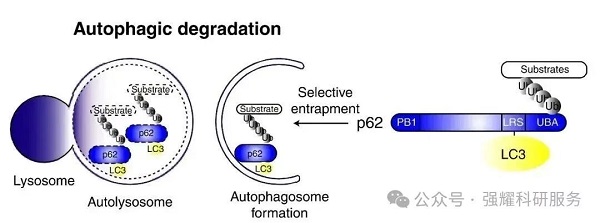
图8. p62介导的选择性自噬模型
(三)WB检测
尽管Western Blot是检测自噬的经典方法,但仅凭其结果不足以独立证实自噬的发生。在条件允许的情况下,建议结合多种检测技术进行相互验证。若条件有限,则应在实验设计中引入自噬激动剂与抑制剂进行干预,通过正反两方面的证据来确证自噬过程。
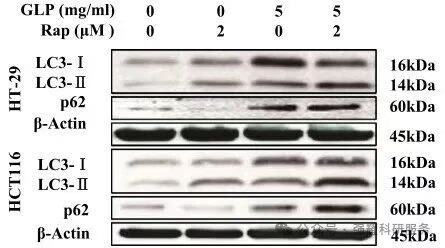
图9. WB检测LC3、p62蛋白的表达
自噬检测方法对比
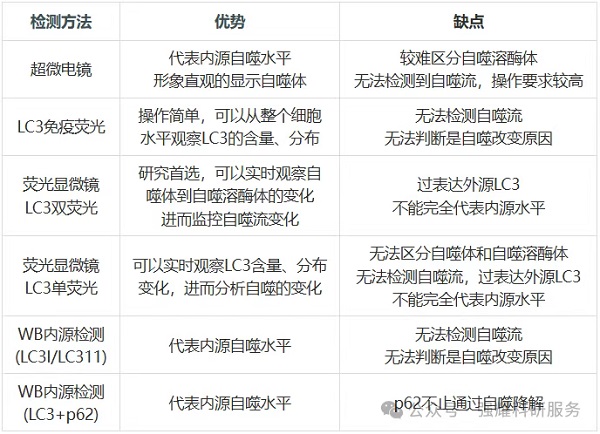
三、自噬研究思路
自噬与肿瘤的文献分享: PDIA6 modulates apoptosis and autophagy of non-small cell lung cancer cells via the MAP4K1/JNK signaling pathway 《EBioMedicine》 Yuxin Bai et al.
1、现象
(1)通过qPCR检测,IHC检测,WB检测以及临床样本检测、存活率分析得知,PDIA6蛋白在NSCLC中表达升高,它会影响到NSCLC的发生。
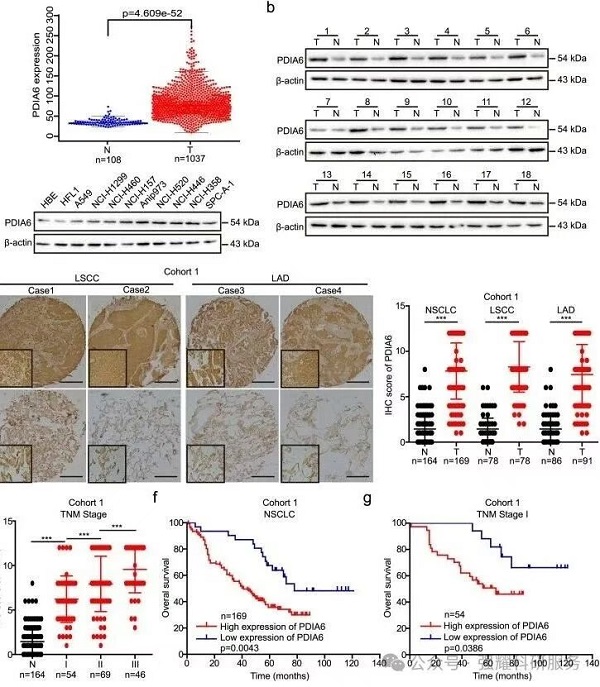
(2)对PDIA6进行干扰表达:通过CCK8实验,克隆形成实验,成瘤实验以及成瘤后IHC实验发现,干扰PDIA6表达后能够明显抑制肿瘤细胞增殖以及肿瘤的发生发生。
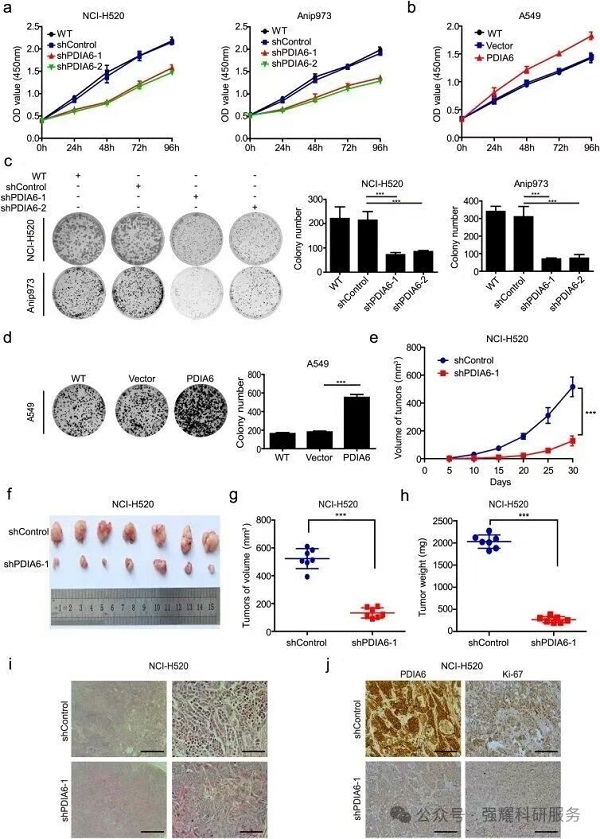
(3)同时发现干扰PDIA6也能够促进肿瘤细胞凋亡。
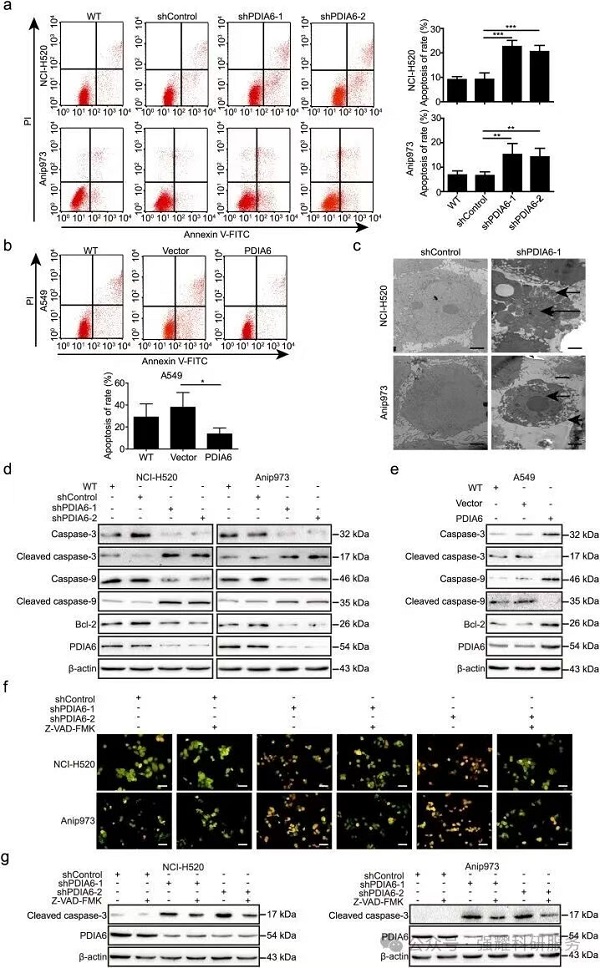
2、本质
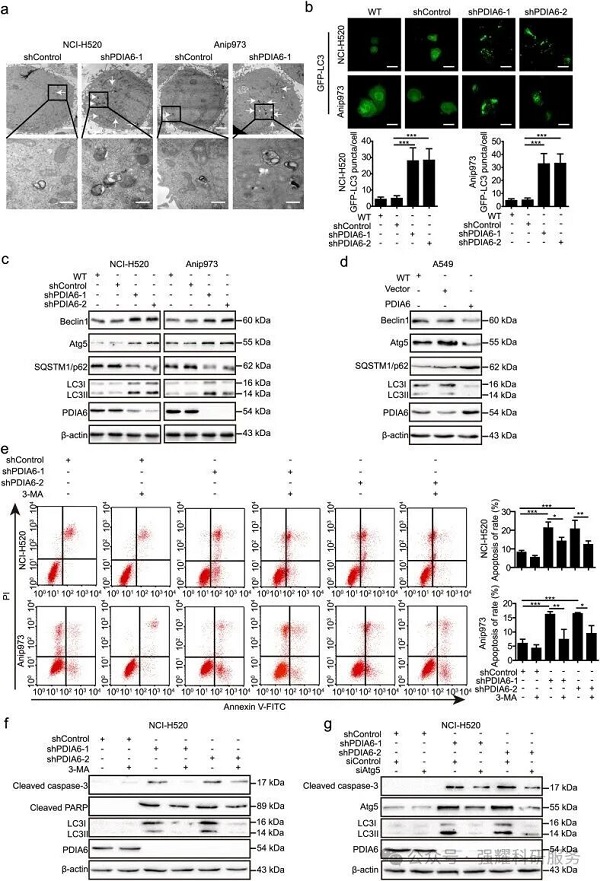
(1)干扰PDIA6能够促进细胞的自噬水平。
(2)干扰PDIA6能够增加细胞的自噬水平,同时细胞凋亡水平也升高,但是这种现象被3-MA(自噬抑制剂)所抑制。
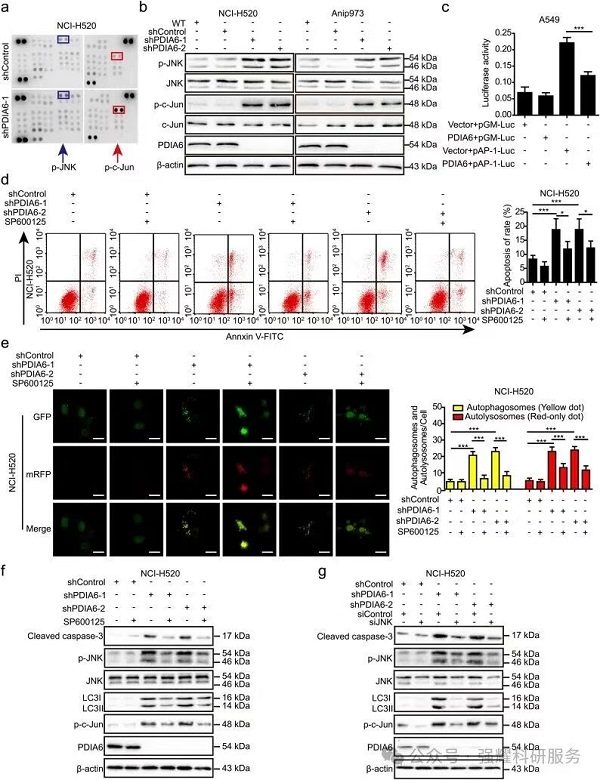
3、机制
(1)通过蛋白芯片检测可得知,干扰PDIA6通过JNK和c-Jun引起肿瘤细胞的自噬和凋亡,并引起p-JNK和p-c-Jun升高。
(2)通过SP600125(JNK inhibitor)作用可发现,其能够逆转PDIA6的促进自噬和凋亡的作用。
强耀生物可提供多肽合成、蛋白表达、抗体制备等优秀服务助力科研,欢迎您咨询订购


 联系我们
联系我们
 返回
返回